Antistoff
Antistoff eller immunglobulin er kroppseigne eggekviteemne. Dei skal klassifiserast som globulin og finst i blod og andre kroppsvæsker hjå ryggbeinsdyr (Vertebrata). Antistoffsproduksjon inngår i det humorale immunsystemet og er ein reaksjon på ulike immunogen. Antistoff skal oppdaga og reagera med antigen og på det viset nøytralisera og gjera ulike kroppsframande emne som til dømes virus og bakteriar uskadelege. På grunn av dei viktige funksjonane i framfor alt det humorale immunsystemet nyttar ein òg omgrepet immunglobulin (Ig).
Funksjon
endreAntistoff har i prinsipp 2 skilde funksjonar. Dei skal både identifisera og binda seg til framande emne og få andre celler og molekyl på å gå til åtak på til dømes mikroorganismar.
Den antigen-bindande regionen på antistoffet bind seg til sin særskilde antigene epitop der han skal passa som «nykelen i nykelhòlet». Dermed kan antigenet blokkerast, og den verknaden til dømes bakteriegifter kan ha på andre kroppsceller vert nøytralisert.
Eit antistoff kan binda antigen på 2 stader i ikkje-kovalente bindingar og klumpa i hop seg saman med antigen (agglutinasjon) i samsvar med mengdelova. Difor oppstår helst agglutinasjonsreaksjonar når antigen- og antistoffsmengdene er om lag like. Ved store avvik åt det eine eller det andre haldet held kompleksa fram med å vera i løyseleg form. Dette kan til dømes gjeva falskt negative resultat i laboratorietestar (prozonefenomen).[1] Den nøytraliserande antistoffsverknaden forsvinn derimot som oftast ikkje.
Det hender at andre og like eller liknande «nyklar» eller epitopar passar inn på den antigenbindande regionen og vera årsak til krossreaksjon med andre antigen. I unnatakstilfelle kan til og med strukturar i kroppseigne substansar framkalla reaksjonar og mellom anna ligga bakom autoimmunsjukdomar.
Antistoff kan dessutan setja ei gang ei reaksjonskjede der celler og molekyl går til åtak på t.d. mikroorganismar. Antistoff spelar ei viktig rolle ved aktivring av komplementsystemet. I tillegg kan dei binda seg til og «kle inn» kroppsframande emne. Fagocyttar kjenner lettare att slike antistoffsmarkerte emne som dei kan «sluka» og bryta ned (opsonering).
Naturlege drepeceller (natural killer cells, NK-celler) vert òg aktiverte og går til åtak på målceller som er «kledde» med antistoff.
Struktur
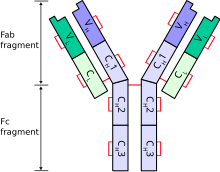
endreGrunneininga er eit antistoffmolekyl (monomer) bygd opp av 4 polypeptidkjeder: 2 par like og lette L-kjeder (L - light chains) med molekylvekt på 25 kDa og 2 par like og tunge H-kjeder (H-heavy chains) med molekylvekt på 50 kDa. Dei lette kjedene har 1 variabel og 1 konstant domene som går under nemningane VL og CL. I dei tunge kjedene er det 1 variabel (VH) og 3–4 konstante domene (CH1, CH2, CH3 o.s.v.). Skjematisk er kjedene samansette i Y-form med kovalente disulfidbruer som held i hop strukturen. H-kjedene dannar gaffelskaftet. H- og L-kjedene bygger til saman dei to greinene av Y-gaffelen. Gaffelskaftfragmentet kallast Fc-fragment (fragment crystallizable). Dei to gaffelgreinene dannar kvart sitt Fab-fragment (fragment antigen binding). I eitt og same molekyl er både dei 2 lette og dei 2 tunge kjedene alltid like. Fab-fragmenta kan spjelkast enzymatisk frå Fc-fragmentet med papain.
Antistoffmolekylet har området for antigenbinding lengst ute i enden på Y-greina. Ulike antigen krev ulike antistoff. I den antigenbindande regionen har difor både H- og L-kjeda særs skiftande aminosyresekvensar. Dette området vert kalla for V (variabel)-regionen. Med hjelp av variasjonar i både H- og L-kjeda i denne molekylregionen kan minst mogelege antistoffstypar oppstå. På grunn av den særskilde strukturen går regionen under nemninga idiopatisk determinant. Dei store variasjonane i V-regionen er grunna på tilfeldige kombinasjonar i eit genesett som kodar for ulike antigene bindingsstelle. Ytterlegare brigde kjem til stand både av tilfeldige mutasjonar i same geneområde og gjennom rekombinasjonar[2]. Etter måten få gen kan på så vis skapa mange variasjonar.
Forutan V-regionen er resten av antistoffmolekylet konstant og kallast C-regionen. Her inngår 1 domene frå L-kjeda (CL) og 3–4 domene frå H-kjeda (CH). Vi har 2 slags CL-kjeder – kappa(κ) og lambda(λ). Eit antistoffsmolekyl har anten 2 kappa- eller 2 lambdakjeder, men aldrig ei kjede av kvar type. I humanantistoff finst om lag 60 % kappa og 40 % lambda. Funksjonelt er det ingen kjend skilnad mellom lette kjeder med kappa eller lambda.
Strukturen i den tunge H-kjeda avgjer antistoffsklasse (isotype). Variasjonar i CH-domena gjev ulike isotypar, men kvar isotype har identiske domene. Dette gjer ein einaste antistoff i stand til å fungera på ulike stader i immunsystemet.
På antistoffsmolekylet står dei særs varierande strukturane i V-regionen for antistoffsbindande funksjonar medan den meir konstante C-regionen står for dei andre aktiveringsmekanismane. B-cellereseptorar kan berre binda antigen. Her saknar den membranbundne C-regionen evne til å aktivera andre forsvarsmekanismar.
Antistoffproduksjon
endreMinst 4 celletypar samverkar ved framstilling av antistoff: antigenpresenterande celler (til dømes ulike dendrittceller, makrofagar, aktiverte B-celler og 2 typar regulerande T-lymfocyttar: hjelpar T-celler (TH) og dempande, suppressor T-celler (TS). Sjølve antistoffsproduksjonen går for seg i B-celler og i plasmaceller (mogne B-celler). B-celler vert produserte i beinmergen. Ei B-celle er førprogrammert til å framstille berre ein særskilt VH- og VL-domene. Immunogene epitopar stimulerer slike B-celler til spesifikk antistoffsproduksjon. Denne eigenskapen går sidan i arv til dottercellene som sidan produserer same VH og VL. Myelom er ein sjukdom med ukontrollert auking av ein celleklon og produksjon av store mengder identiske antistoffsprotein.
Vi kan tala om to typar immunaktivering. Den eine aktiveringstypen tarv og den andre tarv ikkje hjelp av T-lymfocyttar frå thymus: (T cell-dependent og T cell-independent acitvating).[3][treng kjelde]
A. Aktivering av antistoffproduksjon med hjelp av T-lymfocyttar.
Dei fleste immunogene substansar er avhengige av hjelp frå T-lymfocyttar om maksimal antistoffsproduksjon skal koma i gang. T–lymfocyttar kan ikkje reagera på einsamt presenterte immunogen. Gjennom endocytose lyt immunogenet fyrst takast opp i antigenpresenterande celler (B-celler, dendrittceller, makrofagar). Her vert eggekviteemne på immunogenet melta ned til peptid som saman med MHC-antigen klasse II.[4][treng kjelde] i dei antigenpresenterande cellene dannar eit kompleks. Frå slike aktiverte, antigenpresenterande celler går så aktiveringssignal til T-lymfocyttane. Desse svarer i sin tur med å mogna til celletypar med to ulike funksjonar: effektorceller (TH) og minnesceller.
I meste steg vert B-celler spesifikt aktiverte av TH til å starta ein spesifikk antistoffsproduksjon. Ved fyrste stimulering vert ei B-celle aktivert og svarar med produksjon av så godt som berre IgM-antistoff. Ved seinare konfrontasjon med same immunogene epitop tek B-cella til å dela seg og framstilla immunglobulin av lempeleg isotype. Alle B-celler eksisterer såleis som klonar, og kvar dottercelleklon framstiller immunglobulin med identiske bindingseigenskapar. Berre antistoffsklasse (isotype) kan endrast (class switching).[5][treng kjelde] Såleis kan B-celler under mognadsprosessen gå frå å uttrykka berre IgM og IgD til å produsera både IgG, IgA og IgE. Under prosessen mognar mange utav dottercellene til plasmaceller. Desse døyr etter få dagar. B-minnesceller lever derimot vidare.
T- minnesceller kan seinare kjenna att komplekset av immunogen og MHC-antigen klasse II og skikka aktiveringssignal til B-minnesceller. Ved ny eksposisjon for same immunogen har klonal ekspansjon gjort fleire antigenspesifikke B-celler tilgjenglege for antistoffsframstilling. antistoffsproduksjonen kjem då i gang snøggare og vert starkare. Samstundes gjer høgare affinitet med betre binding til antigenet sekundære antistoff meir effektive. På grunn av klonal ekspansjon er det sekundære immunsvaret såleis både snøggare og sterkare og gjev dessutan antistoff av betre kvalitet.
B. Aktivering av antistoffsproduksjon utan hjelp av T-lymfocyttar
Av di B-celler kan oppfatta nokre emne i naturleg tilstand som framande og dermed som immunogene, kan dei i av og til aktiverast utan hjelp av T-lymfocyttar og. Ei B-celle har intracellulært produserte antistoff av type IgM (og IgD) på ytemembranen. Desse antistoffa er utstyrte med særskilte VH- og VL-domene for denne B-cella. Ein slik antistoff fungerer som antigenreseptor og kallast B-cellereseptor (BCR).
Når slike reseptorar fangar opp eit immunogen, svarer B-cella direkte med å framstille så godt som berre IgM-antistoff med same VH- og VL–domene som antigenreseptoren. Denne snøgge typen av immunsvar gjev eit dårleg immunologisk minne. Bakterielle polysakkarid er døme på slike immunogen. Endotoksin kan aktivera antistoffsproduksjon både med og utan hjelp av T-lymfocyttar.
Antistoffklasser (isotypar) i humant immunglobulin
endreIgM (immunglobulin M) er utviklingshistorisk truleg den eldste antistoffstypen. IgM er det fyrste spesifikke immunglobulinet som vert produsert ved primærkontakt med eit immunogen og kan påvisast i akutt infeksjonsfase. IgM-produksjon er uttrykk for eit primært immunsvar. IgM er eit stort molekyl der 5 grunneiningar (pentamer) som vert haldne saman av ei cysteinrik J(join)-kjede. På grunn av molekylstorleiken har det vanskar med å penetrera ut i kroppsvev, og i svangerskapet kan det ikkje passera morkaka (placenta). IgM-molekylet kan binda antigen på 10 ulike stader og har difor sterk agglutinasjonsevne. Pentamerkomplekset aktiverar komplementsystemet på klassisk veg. Reaksjonar i ABO-blodgruppesystemet er IgM-medierte. Som antigenreseptor på B-celler (BCR) ligg IgM føre i monomerisk form.
IgG (immunglobulin G) kjem seinare enn IgM (etter om lag 3 veker) og er uttrykk for eit sekundært og meir moge immunsvar som held seg lenge. Funn av spesifikt IgG kan tyda på både pågåande og gjennomgangen infeksjon eller vaksinasjon. IgG er eit mindre molekyl som har lett for å trengja ut i kroppsvev. IgG er det einaste immunglobulinet som kan passera morkaka. Det kan såleis gjeva det nyfødde barnet ein viss passiv, humoral immunitet dei fyrste månadene. Liten molekylstorleik og ein aktiv prosess som kan tilskrivast reseptorar for Fc-luten av IgG i placenta fremjar passering av morkaka. I serum er IgG den viktigaste antistoffen. Vi har 4 underklasser: IgG1, IgG2, IgG3 og IgG4 (i minkande konsentrasjon). IgG kan både inaktivera mikroorganismar direkte og dessutan setja i gang andre immunreaksjonar ved å aktivera komplement. Både IgG1 og IgG3 (og i måttleg grad IgG2) aktiverer komplement. IgG2 og IgG4 reagerer helst med kolhydratantigen. Rhesusantistoff er av IgG-type. Desse kan penetrera placenta og vera årsak til komplikasjonar i svangerskapet.
IgA (immunglobulin A) finst på alle slimhinner i luftvegar og auge, i mage-tarmkanalen og i urogenitalsystemet. Dessutan skil særskilde kjertlar kring brystvortene ut IgA som kan verna både lokalt og nyfødde barn mot infeksjonar (ved amming). IgA er den viktigaste antistoffen på slimhinnene. Det finst eigentleg i 3 former – i serum for det meste i monomerisk form (einskilde grunneiningar) og dessutan i små mengder i dimerisk form (2 grunneiningar samanbundne av ei ekstra polypeptidkjede - J chain): IgA1. Sekretorisk IgA på slimhinnene er dimerisk: IgA2. I tillegg til 2 grunneiningar har det eit ekstra protein som kallast sekresjonskomponent. Denne sekresjonskomponenten er heilt avgjerande for vernet mot mikroorganismar på slimhinnene.
IgD (immunglobulin D) finst på både mogne og naive B-celler. Saman med IgM fungerer denne monomeriske antistoffen som antigenreseptor og medverkar truleg til å kontrollera lymfocyttaktiveringa når B-celler vert stimulerte til differensiering og klonal kløyving. I serum og lymfe finn vi berre små mengder IgD.
IgE (immunglobulin E) er ein monomerisk antistoff om knappast finst i serum. Mest alle IgE-antistoff er bundne til membranar – framfor alt har mastceller og basofile granulocyttar særskilde Fc-reseptorar for IgE. IgE spelar ei viktig rolle i det immunologisk vernet mot parasittar, fyrst og fremst mot innvolsormar. Mekanismen er ikkje heilt kjend, men IgE er òg viktig når immunsystemet skal spora kreftceller og starta cytotoksiske cellereaksjonar. Når IgE spesifikt kjenner att eit antigen som kan framkalla allergisk reaksjon (allergen), kan det via membranreseptorar frigjera histamin og andre mediatorar frå mastceller og basofile granulocyttar. Slike emne verkar sterkt utvidande på blodkar og kan vera årsak til drastisk blodtrykksenking og sjokk som ved hypersensitivitetsreaksjon av type 1.
Medisinsk behandling
endreEin infeksjonssjukdom fører til produksjon av antistoff. Etter injeksjon av immunglobulin frå slike pasientar kan andre individ for nokre veker til månader få immunitet mot same infeksjon (passiv immunitet). Tidlegare vart ofte antistoff frå dyr nytta til å skapa passiv immunitet. Store risk for allergiske reaksjonar mot dyreantistoff gjer att det no stort sett berre er humane antistoff som nyttast til passiv immunisering.
Med kloningsteknikk kan ein i nyare tid framstilla monoklonale antistoff. Slike antistoff kan vera retta mot inflammasjonsfremjande emne (cytokin, TNF) og direkte gripa inn i inflammasjonsprosessen. Dette kan nyttast ved behandling av t.d. autoimmunsjukdomar. Monoklonale antistoff kan òg koplast til både diagnostiske (t.d. ved scintigrafi) og medisinsk aktive (t.d. cytotoksiske og radioaktive) emne og såleis nyttast som ”sporhundar” som kan leida aktive emne til målorgan og målceller.
Forsking
endreAntistoff i immunologiske laboratorietestar:
antistoff har særs stor spesifisitet. Kopla til raude blodkroppar eller latexpartiklar vert antistoff nytta til å gjera reaksjonen i t.d. hemagglutinasjons- og latexpartikkeltestar synleg.
I komplementbindingstestar kjem dessutan deira evne til å aktivera komplement til nytte.
I andre immunologiske testtypar er antistoff kopla til ulike diagnostiske emne, t.d. radioaktive isotopar eller enzym. I indirekte testar har sensitiviteten auka ytterlegare ved att antistoff frå ulike spesies (dyr) vert nytta som antigen i sekundære antigen-antistoffsreaksjonar.
Med hjelp av ELISA/EIA-testar (enzyme immuno sorbent assay/enzyme immuno assay) kan antistoff og/eller antigen i serum påvisast både kvalitativt og kvantitativt.
Eit liknande prinsipp ligg òg bakom dei kvalitative testane Western Blot og ELISPOT. Her har ein auka spesifisiteten ved å spjelka opp antigenet i ulike antigene epitopar. Immunhistokjemisk kan antigen-antistoffsreaksjonar nyttast til å gjera visse vevs- eller celletypar synlege.
Eit annleis prinsipp ligg bakom væskestraumcytometri. Her kan store cellemengder bundne til antistoff merkte med ulike fluorescerande emne analyserast og kvantifiserast med hjelp av laserstrålar, t.d. ulike blod- og kreftceller.
Kjelder
endre- ↑ Smith G, Holman RP (2004) «The prozone phenomenon with syphilis and HIV-1 co-infection Arkivert 2012-11-03 ved Wayback Machine.»> South Med J., bind 97, nr. 4, s. 379-382. PMID 15108832.
- ↑ Wu X, Feng J, Komori A, Kim EC, Zan H, Casali P (2003) «Immunoglobulin somatic hypermutation: double-strand DNA breaks, AID and error-prone DNA repair» - J Clin Immunol., bind 23, nr. 4, s. 235-246. DOI: 10.1023/A:1024571714867. PMID12959216 (samandrag).
- ↑ Wikipedia (en). B cell. http://en.wikipedia.org/wiki/B_cell
- ↑ Wikipedia (en). Major histocompatibility complex. http://en.wikipedia.org/wiki/Major_histocompatibility_complex
- ↑ Wikipedia (en). Immunoglobulin class switching. http://en.wikipedia.org/wiki/Immunoglobulin_class_switching
Litteratur
endre- Chapel H, Haeney M (1993) Essentials of clinical Immunology, 3. utg., Blackwell Scientific Publications, Oxford, ISBN 0-632-03366-5.
- Delves PJ, Martin SJ, Burton DR, Roitt IM (red., 2006) Roitt´s Essential Immunology, 11. utg., Blackwell Publishing Ltd., Oxford. ISBN 978-1-4051-3603-7.
Bakgrunnsstoff
endre- Antistoffer i Store Medisinske Leksikon