Sigdcelleanemi
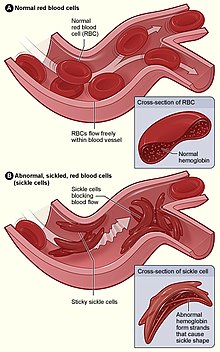
Sigdcelleanemi eller sigdcellesjukdom (og sjeldan drepanocytose) er ein recessivt nedarva blodsjukdom som er kjenneteikna ved sjuklege avvik i dei oksygenberande hemoglobinmolekyla i raude blodceller. Dette fører til ein dragnad i cellene mot å omforme seg til harde og sigdforma celler under visse forhold. Sigdcelleanemi er tilknytt ulike akutte og kroniske helseproblem, som til dømes infeksjonar, bråe smerteåtak («sigdcellekrise») og slag, i tillegg til aukt risiko for død. Anemien oppstår når ein person arvar to abnorme kopiar av hemoglobingenet, éin frå kvar av foreldra. Det finst mange undertypar avhengig av den eksakte mutasjonen i kvart av gena. Dei som berre arvar eitt abnormt gen plar ikkje vise symptom, og blir gjerne kalla «ein berar av sjukdommen». Ein kan også seie at personen har sickle cell trait («sigdcelle-trekk»).[1]
Komplikasjonane ved sigdcelleanemi kan i stor grad førebyggjast med vaksinasjon, profylaktisk antibiotika, blodoverføring, og med lækjemiddelet hydroksyurea/hydroksykarbamid. Ein liten del av pasientane treng transplantasjon av beinmergsceller.
Kring 300 000 barn vert fødde med ein variant av sigdcelleanemi kvart år, i hovudsak i Afrika sør for Sahara, men også i andre land i til dømes Karibia og Sør-Asia, og hjå folk av afrikansk opphav andre stader i verda. Tilstanden vart fyrste gong skildra i medisinsk litteratur av den amerikanske legen James Bryan Herrick i 1910. Frå 1940 og utover 50-åra førte bidrag frå nobelprisvinnaren Linus Pauling til at sjukdommen vart den fyrste i verda der den eksakte genetiske og molekylære defekten var klårgjort.
Symptom og sjukdomsteikn
endreSigdcelleanemi kan føre til ulike akutte og kroniske komplikasjonar, fleire av desse med høg dødsprosent.[2]
Sigdcellekrise
endreOmgrepet «sigdcellekrise» blir bruka for å skildre ulike akutte og uavhengige tilstandar som oppstår hjå folk med sigdcelleanemi. Sigdcelleanemi fører til anemi og ulike slag av kriser, medrekna vasookklusiv krise, aplastisk krise, sekvestreringskrise, hemolytisk krise og andre. Dei fleste krisene står ved lag i mellom fem og sju dagar.[3] Infeksjon, dehydrering og acidose (som alle dreg fordel av sigdcelledanning) kan medverka til å utløyse krisene, men som oftast finn ein ikkje noka føreliggjande årsak.[4]
Vasookklusiv krise
endreVasookklusiv krise oppstår når sigdcelleforma raude blodceller stengjer av hårrøyrsårer og stoggar blodstraumen til eit organ. Dette vil om senn føre til iskemi, smerte, nekrose og ofte organskade. Førekomsten, alvoret og lengda av krisane varierer monaleg. Smertefulle kriser vert behandla med hydrering, analgetika og blodoverføring. I tillegg blir det gjeve opioidar med jamne mellomrom fram til krisa har roa seg. Ved mildare kriser kan det vere tilstrekkeleg med ikkje-steroide antiinflammatoriske middel (til dømes diklofenak og naproksen). Ved meir alvorlege kriser vil pasienten trenge døgnbehandling med intravenøse opiodar; pasientkontrollert smertebehandling er vanleg i desse tilfella. Vasookklusive kriser som rammar penis[5] eller lunger er eit medisinsk naudhøve, og vert behandla med blodoverføring. Insentiv spirometri, ein teknikk som fremjer djup pusting for å hindre utviklinga av atelaktase, er tilrådd.[6]
Splenisk sekvestreringskrise
endreMilten er eit organ som jobbar med å fjerne sundbrotne raude blodceller. Blodårene i dette organet er tronge, noko som medfører at milten ofte blir ramma av kriser.[7] Folk med sigdcelleanemi plar å få infarkt i milten undervegs i barndomen. Denne autosplenektomien aukar risikoen for infeksjon frå innkapsla bakteriar;[8][9] profylaktisk antibiotika og vaksinasjonar er tilrådd hjå folk med denne typen aspleni.
Sekvestreringskrise er ei akutt og smertefull oppsvelling av milten som følgje av opphopinga av raude blodceller. Dette fører til eit stupbratt fall i hemoglobinnivået med fare for hypovolemisk sjokk. Sekvestreringskriser blir rekna som medisinske naudhøver. Mangel på behandling kan føre til sirkulasjonssvikt og fylgjeleg død etter få timar. Behandlinga er palliativ (lindrande), stundom med blodoverføring. Krisene er forbigåande, og står ved lag i 3–4 timar eller opptil ein dag.[10]
Akutt brystsyndrom
endreAkutt brystsyndrom er kjenneteikna ved førekomsten av nye lungeinfiltrat med manifestasjonar som takypné og dyspné.[11] Det er den nest vanlegaste komplikasjonen og utgjer omkring 25 % av dødsfalla hjå pasientar med sigdcelleanemi. Storparten av tilfella oppstår i kombinasjon med vasookklusive kriser, etterfylgd av sigdcelleanemi.[11][12] 80 % av pasientane får vasookklusive kriser ved sigdcelleanemi.
Aplastisk krise
endreAplastiske kriser er akutte forverringar av anemien som fører til bleikskap, takykardi og trøyttleik. Krisene vert oftast utløyst av parvovirus B19, som har direkte verknad på produksjonen av raude blodceller, fordi viruset trengjer inn i forlauparane til dei raude cellene. Viruset kløyver seg inni cella og øydelegg ho.[13] Parvovirusinfeksjonar stoggar produksjonen av raude blodlekamar i to til tre dagar. Dette har liten innverknad på folk flest, men den korte levetida til raude blodceller hjå personar med sigdcelleanemi fører til ei brå og livstrugande krise. Talet på retikulocyttar minskar monaleg undervegs i sjukdommen, noko som fører til retikulocytopeni, og den snøgge omskiftinga av raude blodceller fører til at hemoglobinnivå fell. Krisen står ved lag i 4–7 dagar. Storparten av pasientane kan behandlast palliativt, og nokre treng blodoverføring.[14]
Hemolytisk krise
endreHemolytiske kriser er akutte og akselererte fall i hemoglobinnivå. Dei raude blodcellene vert snøggare nedbrotne. Dette er særskild vanleg hjå pasientar med G6PD-mangel.[15] Behandlinga er palliativ, og somme gonger med blodoverføring.[6]
Andre
endreEin av dei fyrste kliniske manifestasjonane er daktylitt, som kan oppstå tidleg i ein alder av seks månadar, også i folk med berre eitt abnormt gen.[16] Krisen kan stå ved lag i opptil éin månad.[17] Akutt brystsyndrom er kjenneteikna ved feber, brystsmerte, pustevanskar og lungeinfiltrat på røntgen. Både lungebetennelse og sigdcelledanning kan føre til desse symptoma, så det er vanleg å behandle begge tilstandane.[18] Syndromet kan utløysast av smertefulle kriser, luftvegsinfeksjonar, beinmergsembolisering, atelaktase, opiatar og kirurgi.
Komplikasjonar
endreSigdcelleanemi kan føre til ulike komplikasjonar:
|
|
|
Genetikk
endreNormalt har menneske hemoglobin A, som er samansett av to alfa- og to betakjeder, hemoglobin A2, som er samansett av to alfa- og to deltakjeder, og hemoglobin F, som er samansett av to alfa- og to gammakjeder. Av desse er hemoglobin F dominerande fram til ein alder av seks veker, før hemoglobin A vert dominerande resten av livet.
Sigdcellesjukdommar har eit autosomalt recessivt arvemønster frå foreldra. Kva for typar hemoglobin ein person lagar i dei raude blodlekamane avhenger av kva for hemoglobin-gen som er nedarva frå foreldra. Viss ein av foreldra har sigdcelleanemi og den andre er «berar av sjukdommen», så har barnet 50 % sjanse for å få sigdcellesjukdom og 50 % sjanse for å verta «berar av sjukdommen». Når begge foreldra er berarar, så har barnet 25 % sjanse for å få sigdcellesjukdom; 25 % vil ikkje bere sigdcelle-allel i det heile, og 50 % vil få den heterozygote tilstanden.
Genmutasjonen i sigdcelleanemi oppstod truleg spontant i fleire ulike geografiske område, i følgje endonuklease-analysar. Desse variantane er kjend som Cameroon («Kamerun»), Senegal, Benin, Bantu og Saudi-Asian («saudi-asiatisk»). Dei har klinisk relevans fordi nokre av dei har tilknyting til høgare HbF-nivå (fosterhemoglobin), til dømes Senegal- og Saudi-Asian-variantane, og dei plar å bringe mildare sjukdom.[31]
I personar som er heterozygote for HgbS (berarar av sigdcelle-hemoglobin) er polymeriseringsproblema minimale fordi den normale allelet er i stand til å danne over 50 % av hemoglobinet. I personar som er homozygote for HgbS vil tilstadeveringa av lange HbS-polymerkjeder øydeleggje forma til dei raude blodlekamane — frå ei glatt smultringform til ein ujamn og naglete form. Dette gjer cella skjør og mottakelig for å knekke inni kapillærane. Berarar vil berre vise symptom når dei har oksygenmangel (til dømes ved fjellklatring) eller når dei er kraftig dehydrert. Sigdcellesjukdommen oppstår når den sjette aminosyra, glutaminsyre, vert erstatta av valin, slik at strukturen og funksjonen vert endra; på grunn av dette er sigdcelleanemi også kjend som E6V. Valin er hydrofob, noko som gjer at hemoglobinet stundom kollapsar. Strukturen vert forøvrig ikkje endra. Når ei tilstrekkeleg mengd av hemoglobin kollapsar så vil den raude blodlekamen verta sigdforma.
Genfeilen er ein kjend mutasjon i eit enkelt nukleotid (sjå enkeltnukleotidpolymorfi) (A til T) i β-globingenet, som fører til at glutaminsyre vert erstatta av valin ved posisjon 6. Når denne mutasjonen oppstår i hemoglobin S vert det kalla HbS, i motsetnad til den normale HbA. Den genetiske lidinga skuldast mutasjon av ein enkelt nukleotid, frå GAG til GTG kodon på den kodande tråden, som vert transkribert til eit GUG kodon. Dette er vanlegvis ein godarta mutasjon, utan innverknad på den sekundære, tertiære eller kvaternære strukturen i hemoglobin ved normale oksygenkonsentrasjonar. Ved låge oksygennivå kan det oppstå ei polymerisering av HbS. Den deoksygenerte forma av hemoglobin eksponerar ein hydrofob flekk på proteinet mellom E- og F-spiralane (heliksane). Dei hydrofobe reststoffa av valin på posisjon 6 i betakjeden (i hemoglobin) er i stand til å assosiere seg med den hydrofobe flekken, slik at hemoglobin S-molekylet aggregerar og dannar fibrøse presipitat.
Allelet som er ansvarleg for sigdcelleanemi finst på den korte armen (p-armen) på kromosom 11, meir spesifikt 11p15. Ein person som arvar det defekte genet frå både far og mor vil utvikle sjukdommen; ein person som arvar eitt defekt og eitt friskt allel held seg frisk, men kan passere sjukdommen vidare og vil òg verte ein berar (eller heterozygot). Heterozygotar kan smittast av malaria, men symptoma er generelt mindre alvorlege.[32]
På grunn av den adaptive fordelen til heterozygotar så er sjukdommen fortsatt utbreidd, særleg blant folk av nyare opphav i malaria-ramma området, som til dømes Afrika, Middelhavsområda, India og Midt-Austen.[33] Malaria var i utgangspunktet endemisk for sør-Europa, men det vart erklært utrydda på midten av 1900-talet, med unntak av sjeldne sporadiske tilfeller.[34]
Malariaparasitten har ein kompleks livssyklus og tilbringer delar av livet i raude blodlekamar. I ein berar av malariaparasitten så vil parasitten føre til at dei raude blodlekamane sprekk for tidleg, slik at Plasmodiumparasitten ikkje er i stand til å formeire seg. Vidare vil polymeriseringa av hemoglobin påverke parasitten si evne til å fordøye hemoglobinet. Dette fører til at folk som bur i områder med malaria har ein større moglegheit for å overleve viss dei har sigdcellegenet.
Patofysiologi
endreTapet av elastisitet i dei raude blodlekamane er ein viktig del av patofysiologien i sigdcelleanemi. Normale raude blodlekamar er veldig elastiske, som gjer at cellene kan omforme seg for å kome seg gjennom kapillærar. I sigdcelleanemi så vil låge oksygennivå auke trykket og dimed også sigdcelledanninga. Gjentekne episodar av sigdcelledanning fører til at cellemembranen vert skada og elastisiteten minska. Cellene klarar ikkje å returnere til si normale form når oksygentrykket aukar. Som følgje av dette så klarar ikkje dei stive lekamane å omforme seg når dei strøymer gjennom kapillærane, noko som fører til okklusjon og iskemi.
Anemien skuldast hemolyse, øydelegging av raude blodlekamar, på grunn av forma deira. Beinmergen prøver å kompensere ved å lage nye blodlekamar, men nedbrytinga får mykje fortare.[35] Friske raude blodlekamar har ei levetid på 90—120 dagar, medan sigdceller berre lever i 10—20 dagar.[36]
Diagnose
endreVed HbSS vil fullstendig blodtelling vise hemoglobinnivå i området 6—8 g/dl med høge retikulocyttverdiar (sidan beinmergen kompenserar for øydelegginga av sigdceller ved å danne fleire raude blodlekamar). I andre former av sigdcelleanemi plar Hb-nivåa vere høgare. Ein blodfilm kan vise teikn på hyposplenisme (codocyttar og Howell-Jollylekamar).
Sigdcelledanning av raude blodlekamar kan induserast på blodfilm ved å tilsetje natriumetabisulfitt. Tilstadeveringa av sigdcellehemoglobin kan òg demonstrerast med i ei løysing. Ei blanding av hemoglobin S (HbS) i ei reduserande løysing (som til dømes natriumditionitt) gjev ei uklår og grumsete løysing, medan normalt hemoglobin gjev ei klår løysing.
Abnorme former av hemoglobin kan sjåast ved hemoglobinelektroforese, ein form for gelelektrofose der ulike hemoglobintypar flyttar seg i varierande fart. Sigdcellehemoglobin (HgbS) og hemoglobin C med sigdcelledanning (HgbSC) — dei to vanlegaste formene — kan identifiserast på denne måten. Diagnosen kan stadfestast med væskekromatografi. Genetiske undersøkingar vert sjeldan gjort sidan det finst andre undersøkingar som er veldig spesifikke for HbS og HbC.[37]
Ei akutt sigdcellekrise er ofte utfelt av infeksjon. Difor kan det vere nyttig med regelmessig urinanalyse for å leite etter okkult urinvegsinfeksjon, og regelmessig røntgen toraks for å leite etter okkult lungebetennelse.[38]
Folk som er berarar av sjukdommen plar å gjennomgå genetisk rådgjeving før dei får barn. Ufødde barn kan testast for sjukdommen ved å ta blodprøvar frå fosteret, eller ved å ta ein prøve av fostervatnet. Sidan det er risikofylt å ta blodprøvar frå eit foster, så er den sistnemnde vanlegast. Nyføddscreening kan bidra til tidleg oppdaging hjå personar med sigdcelleanemi, og er nyttig i identifiseringa av grupper som berer sjukdommen.[39]
Behandling
endreFolsyre og penicillin
endreBarn med sigdcelleanemi vil bli nøye observert av barnelegen og få behandling av ein hematolog for å halde seg frisk. Pasienten vil ta 1 mg folsyre kvar dag resten av livet. Frå fødselen og fram til dei vert fem år gamle vil dei òg måtte ta penicillin dagleg på grunn av det nedsette immunsystemet som gjer dei utsett for barnesjukdommar.
Malariakjemoprofylakse
endreDen vernande effekten til sigdcelleallelet gjeld ikkje for dei med sigdcelleanemi; faktisk så er dei meir sårbare for malaria sidan den vanlegaste årsaka til smertefulle sigdcellekriser i malaria-ramma land kjem frå infeksjonar med malaria. Det er difor tilrådd at folk med sigdcelleanemi i malaria-ramma land får malariakjemoprofylakse heile livet.[40]
Vasookklusiv krise
endreDei fleste med sigdcelleanemi har intense smerteepisodar kalla vasookklusive kriser. Frekvensen, alvorlegheitsgrada og lengda av krisene varierer veldig. Smertefulle kriser vert handsama symptomatisk med smertestillande; smertehandsaming krev regelmessig administrering av opioidar fram til krisa forsvinn. Ved mildare kriser er det stundom nok med ikkje-steroide antiinflammatoriske middel (til dømes diklofenak og naproksen). Ved meir alvorlege kriser vil pasienten trenge døgnbehandling med intravenøse opiodar; pasientkontrollert smertebehandling er vanleg i desse tilfella. Legen skriv ofte ut difenhydramin for å dempe kløinga som følgjer bruken av opioidar.
Akutt brystkrise
endreHandsaminga er lik den som ved vasookklusiv krise, med tillegg av antibiotika (vanlegvis kinolon eller makrolid),[41] oksygentilskot for hypoksi og nær observasjon. Viss lungeinfiltratet vert verre, eller oksygenkrava større, vil enkle blodoverføringar eller utskiftingstransfusjon vere naudsynleg. Sistnemnde omfattar utskiftinga av store delar av dei raude blodlekamane til pasienten med normale lekamar, som minskar prosentdelen av hemoglobin S i blodet.
Hydroxyurea (medac)
endreDet fyrste godkjende lækjemiddelet for årsakshandsaming av sigdcelleanemi, hydroxyurea medac, viste seg å minske talet på (og alvorlegheitsgrada av) kriser,[42] og kunne moglegvis auke levealderen.[43] Dette skuldast til dels reaktiveringa av fosterhemoglobindanninga, i staden for hemoglobin S som fører til sigdcelleanemi. Hydroxyurea var tidlegare brukt som cellegift, og det er attlete over langtidsverknadane. Risikoen har likevel vist seg å vere anten fråvêrande eller veldig låg, og fordelane er truleg mykje større enn bakdelane.[44]
Blodoverføring
endreBlodoverføringar er ofte brukt ved handsaminga av akutte tilfeller av sigdcelleanemi, og for å førebyggje komplikasjonar ved å senkje talet på raude blodlekamar som kan forme sigdceller ved å tilføre normale raude blodlekamar.[45] Hjå barn kan profylaktisk blodoverføring til ei viss grad minske risikoen for eit fyrste hjerneslag viss Transkraniell Doppler ultrasonografi visar abnorme aukingar av blodstraumsfarten i hjernen. Personar med tidlegare slag har òg vist å ha ei minsking i risikoen for attendevendande slag og ytterlegare stille slag.[46][47]
Beinmergstransplantasjon
endreBeinmergstransplantasjon har vist seg å vere nyttig hjå barn. Beinmergstransplantasjonar er den einaste kjende kuren for sigdcelleanemi.[48] Dei er likevel vanskelege å utføre fordi det krevst ein spesifikk HMA-type. Det ideelle er at ein tvilling (syngen stamcelletransplantasjon) eller nær slektning (allogen stamcelletransplantasjon) donerar beinmergen som trengst for transplantasjonen.
Prognose
endreKring 90 % av pasientar overlever til dei er 20, og nesten 50 % overlever lenger enn fem tiår.[49] Ifølgje ein studie frå Jamaica så var den gjennomsnittlege levetida 53 år for menn og 58 år for kvinner med homozygot sigdcelleanemi i 2001.[50]
Sjå òg
endreKjelder
endre- Denne artikkelen bygger på «Sickle-cell disease» frå Wikipedia på engelsk, den 8. januar 2015.
- Wikipedia på engelsk oppgav desse kjeldene:
- ↑ sickle cell trait [«sigdcelle-trekk»]. Norsk medisinsk ordbok (Det Norske Samlaget). «sickle cell trait — heterozygot arv for sigdcelletilstanden, jf. sigdcelleanemi, tilstanden er symptomfri, men kan te seg m.a. med isostenuri pga lette nyreforandringer»
- ↑ Yawn, BP; Buchanan, GR; Afenyi-Annan, AN; Ballas, SK; Hassell, KL; James, AH; Jordan, L; Lanzkron, SM; Lottenberg, R; Savage, WJ; Tanabe, PJ; Ware, RE; Murad, MH; Goldsmith, JC; Ortiz, E; Fulwood, R; Horton, A; John-Sowah, J (10. september 2014). «Management of sickle cell disease: summary of the 2014 evidence-based report by expert panel members.». JAMA 312 (10): 1033–48.
- ↑ «BestBets: How long should an average sickle cell crisis last?». Henta 27. november 2011.
- ↑ Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson; Aster, Jon (28. mai 2009). Robbins and Cotran Pathologic Basis of Disease, Professional Edition: Expert Consult - Online (Robbins Pathology) (Kindle Locations 33498-33499). Elsevier Health. Kindle Edition.
- ↑ Olujohungbe A; Burnett AL (2013). «How I manage priapism due to sickle cell disease». British Journal of Haematology 160 (6): 754–65.
- ↑ 6,0 6,1 Glassberg J (August 2011). «Evidence-based management of sickle cell disease in the emergency department». Emergency Medicine Practice 13 (8): 1–20; quiz 20.
- ↑ Anie KA; Green J (2012). Anie, Kofi A, red. «Psychological therapies for sickle cell disease and pain». Cochrane Database of Systematic Reviews (Online) 2: CD001916.
- ↑ Pearson HA (August 1977). «Sickle cell anemia and severe infections due to encapsulated bacteria» (Free full text). J Infect Dis. 136 Suppl: S25–30. ISSN 0022-1899.
- ↑ Wong WY, Powars DR, Chan L, Hiti A, Johnson C, Overturf G (Mars 1992). «Polysaccharide encapsulated bacterial infection in sickle cell anaemia: a thirty year epidemiologic experience». Am J Hematol 39 (3): 176–82.
- ↑ Khatib R, Rabah R, Sarnaik SA (Januar 2009). «The spleen in the sickling disorders: an update». Pediatric Radiology 39 (1): 17–22.
- ↑ 11,0 11,1 Dessap AM, Leon R, Habibi A, Nzouakou R, Roudot-Thoraval F, Adnot S, Godeau B, Galacteros F, Brun-Buisson C, Brochard L, Maitre B (2008). «Pulmonary hypertension and cor pulmonale during severe acute chest syndrome in sickle cell disease». Am. J. Respir. Crit. Care Med. 177 (6): 646–53.
- ↑ Paul RN, Castro OL, Aggarwal A, Oneal PA (2011). «Acute chest syndrome: sickle cell disease». Eur. J. Haematol. 87 (3): 191–207.
- ↑ Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson; Aster, Jon (28. mai 2009). Robbins and Cotran Pathologic Basis of Disease, Professional Edition: Expert Consult - Online (Robbins Pathology) (Kindle Location 33329). Elsevier Health. Kindle Edition.
- ↑ Slavov SN, Kashima S, Pinto AC, Covas DT (August 2011). «Human parvovirus B19: general considerations and impact on patients with sickle-cell disease and thalassemia and on blood transfusions». FEMS Immunology and Medical Microbiology 62 (3): 247–62.
- ↑ Balgir RS (Mars 2012). «Community expansion and gene geography of sickle cell trait and G6PD deficiency, and natural selection against malaria: experience from tribal land of India». Cardiovascular & Hematological Agents in Medicinal Chemistry 10 (1): 3–13.
- ↑ Jadavji T, Prober CG (April 1985). «Dactylitis in a child with sickle cell trait». Can Med Assoc J 132 (7): 814–5. ISSN 0008-4409.
- ↑ arkivkopi, arkivert frå originalen 11. april 2009, henta 7. januar 2015
- ↑ Miller ST (Mai 2011). «How I treat acute chest syndrome in children with sickle cell disease». Blood 117 (20): 5297–305.
- ↑ Kavanagh PL, Sprinz PG, Vinci SR, Bauchner H, Wang CJ (2011). «Management of children with sickle cell disease: a comprehensive review of the literature». Pediatrics 128 (6): e1552–74.
- ↑ Adams RJ, Ohene-Frempong K, Wang W (2001). «Sickle cell and the brain». Hematology Am Soc Hematol Educ Program 2001 (1): 31–46.
- ↑ Adams RJ (November 2007). «Big strokes in small persons». Arch. Neurol. 64 (11): 1567–74.
- ↑ Martí-Carvajal A, Dunlop R, Agreda-Perez L (Oktober 2004). Martí-Carvajal, Arturo J, red. «Treatment for avascular necrosis of bone in people with sickle cell disease». Cochrane database of systematic reviews (Online) (4): CD004344.
- ↑ Kenny MW, George AJ, Stuart J (Juli 1980). «Platelet hyperactivity in sickle-cell disease: a consequence of hyposplenism». Journal of Clinical Pathology 33 (7): 622–5. Henta 23. mars 2011.
- ↑ Chrouser KL, Ajiboye OB, Oyetunji TA, Chang DC (April 2011). «Priapism in the United States: the changing role of sickle cell disease». American Journal of Surgery 201 (4): 468–74.
- ↑ Smith WR, Penberthy LT, Bovbjerg VE, McClish DK, Roberts JD, Dahman B, Aisiku IP, Levenson JL, Roseff SD (Januar 2008). «Daily assessment of pain in adults with sickle cell disease». Annals of Internal Medicine 148 (2): 94–101. ISSN 0003-4819.
- ↑ Almeida A, Roberts I (Mai 2005). «Bone involvement in sickle cell disease». Br. J. Haematol. 129 (4): 482–90. Arkivert frå originalen 16. desember 2012. Henta 7. januar 2015.
- ↑ Rudge FW (1991). «Hyperbaric oxygen therapy in the treatment of sickle cell leg ulcers». Undersea and Hyperbaric Medical Society 6 (1): 1–4. Arkivert frå originalen 5. september 2012. Henta 23. mars 2011.
- ↑ Elagouz M, Jyothi S, Gupta B, Sivaprasad S (Juli 2010). «Sickle cell disease and the eye: old and new concepts». Survey of Ophthalmology 55 (4): 359–77. Henta 23. mars 2011.
- ↑ Gladwin MT, Sachdev V, Jison ML, Shizukuda Y, Plehn JF, Minter K, Brown B, Coles WA, Nichols JS, Ernst I, Hunter LA, Blackwelder WC, Schechter AN, Rodgers GP, Castro O, Ognibene FP (Februar 2004). «Pulmonary hypertension as a risk factor for death in patients with sickle cell disease». N. Engl. J. Med. 350 (9): 886–95.
- ↑ Powars DR, Elliott-Mills DD, Chan L, Niland J, Hiti AL, Opas LM, Johnson C (Oktober 1991). «Chronic renal failure in sickle cell disease: risk factors, clinical course, and mortality». Annals of Internal Medicine 115 (8): 614–20. ISSN 0003-4819.
- ↑ Green NS, Fabry ME, Kaptue-Noche L, Nagel RL (Oktober 1993). «Senegal haplotype is associated with higher HbF than Benin and Cameroon haplotypes in African children with sickle cell anemia». Am. J. Hematol. 44 (2): 145–6. ISSN 0361-8609.
- ↑ Allison AC (Oktober 2009). «Genetic control of resistance to human malaria». Current Opinion in Immunology 21 (5): 499–505.
- ↑ Kwiatkowski DP (August 2005). «How Malaria Has Affected the Human Genome and What Human Genetics Can Teach Us about Malaria». Am. J. Hum. Genet. 77 (2): 171–92. ISSN 0002-9297.
- ↑ Ponçon N, Toty C, L'Ambert G, Le Goff G, Brengues C, Schaffner F, Fontenille D (2007). «Biology and dynamics of potential malaria vectors in Southern France». Malar. J. 6: 18.
- ↑ «How Does Sickle Cell Cause Disease?». Henta 27. november 2010.
- ↑ «Sickle Cell Anemia: eMedicine Emergency Medicine». Henta 27. november 2010.
- ↑ Clarke GM, Higgins TN (August 2000). «Laboratory investigation of hemoglobinopathies and thalassemias: review and update». Clin. Chem. 46 (8 Pt 2): 1284–90.
- ↑ «BestBets: Does routine urinalysis and chest radiography detect occult bacterial infection in sickle cell patients presenting to the accident and emergency department with painful crisis?». Henta 27. november 2010.
- ↑ Lee, C., Davies, S.,& Dezatoux, C. (2000). Neonatal Screening for sickle cell disease. The Cochrane Collaboration. John Wiley & Sons, Ltd.
- ↑ Oniyangi O, Omari AA (2006). Oniyangi, Oluseyi, red. «Malaria chemoprophylaxis in sickle cell disease». Cochrane Database of Systematic Reviews 13 (4): CD003489.
- ↑ Aldrich TK, Nagel RL. (1998). «Pulmonary Complications of Sickle Cell Disease.». I Reynolds HY, Bone RC, Dantzker DR, George RB, Matthay RA. Pulmonary and Critical Care Medicine (6th utg.). St. Louis: Mosby. s. 1–10. ISBN 0-8151-1371-4.
- ↑ Charache S, Terrin ML, Moore RD, Dover GJ, Barton FB, Eckert SV, McMahon RP, Bonds DR (Mai 1995). «Effect of hydroxyurea on the frequency of painful crises in sickle cell anemia. Investigators of the Multicenter Study of Hydroxyurea in Sickle Cell Anemia». N. Engl. J. Med. 332 (20): 1317–22. ISSN 0028-4793.
- ↑ Steinberg MH, Barton F, Castro O, Pegelow CH, Ballas SK, Kutlar A, Orringer E, Bellevue R, Olivieri N, Eckman J, Varma M, Ramirez G, Adler B, Smith W, Carlos T, Ataga K, DeCastro L, Bigelow C, Saunthararajah Y, Telfer M, Vichinsky E, Claster S, Shurin S, Bridges K, Waclawiw M, Bonds D, Terrin M (April 2003). «Effect of hydroxyurea on mortality and morbidity in adult sickle cell anemia: risks and benefits up to 9 years of treatment». JAMA 289 (13): 1645–51.
- ↑ Platt OS (Mars 2008). «Hydroxyurea for the treatment of sickle cell anemia». N. Engl. J. Med. 358 (13): 1362–9.
- ↑ Drasar E, Igbineweka N, Vasavda N, Free M, Awogbade M, Allman M, Mijovic A, Thein SL (Mars 2011). «Blood transfusion usage among adults with sickle cell disease - a single institution experience over ten years». Br. J. Haematol. 152 (6): 766–70.
- ↑ Gyang E, Yeom K, Hoppe C, Partap S, Jeng M (Januar 2011). «Effect of chronic red cell transfusion therapy on vasculopathies and silent infarcts in patients with sickle cell disease». Am. J. Hematol. 86 (1): 104–6.
- ↑ Mirre E, Brousse V, Berteloot L, Lambot-Juhan K, Verlhac S, Boulat C, Dumont MD, Lenoir G, de Montalembert M (Mars 2010). «Feasibility and efficacy of chronic transfusion for stroke prevention in children with sickle cell disease». Eur. J. Haematol. 84 (3): 259–65.
- ↑ Walters MC, Patience M, Leisenring W, Eckman JR, Scott JP, Mentzer WC, Davies SC, Ohene-Frempong K, Bernaudin F, Matthews DC, Storb R, Sullivan KM (August 1996). «Bone marrow transplantation for sickle cell disease». N. Engl. J. Med. 335 (6): 369–76.
- ↑ Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson; Aster, Jon (28. mai 2009). Robbins and Cotran Pathologic Basis of Disease, Professional Edition: Expert Consult - Online (Robbins Pathology) (Kindle Locations 33530-33531). Elsevier Health. Kindle Edition.
- ↑ Wierenga KJ, Hambleton IR, Lewis NA (2001). «Survival estimates for patients with homozygous sickle-cell disease in Jamaica: A clinic-based population study». Lancet 357 (9257): 680–683.